【無機化学】スーパー暗記シリーズ1
- けんちゃん
- 2019年6月7日
- 読了時間: 2分
「丸暗記はなるべくしない!理解して覚えよ!」
イーズ化学のモットーです。
丸暗記を減らせば、化学が一気に得意になります!
このシリーズでは、
1. 丸暗記を減らすための理論知識
2. 暗記のコツ・勉強法
を紹介していきたいと思います!
今日のテーマは「気体発生反応の覚え方 硫酸ver」です!
〇硫酸の性質を知ろう!
硫酸は、濃硫酸と希硫酸に分けて性質を覚えましょう。
・濃硫酸
不揮発性→「揮発性酸の遊離反応」
脱水性 →「脱水反応」
吸湿性 →「乾燥剤」として利用
酸化性(高温のときだけ)→「酸化還元反応」
・希硫酸
強酸性 →「弱酸の遊離反応」
気体発生反応で硫酸が出てきたら、これらのいずれかを使った反応になります。
まずはこの5つの性質を覚えよう!
〇不揮発性
濃硫酸の不揮発性を使うと、「揮発性酸の遊離反応」が起こせます!
・作れる気体
塩化水素HCl、フッ化水素HF
・化学反応式

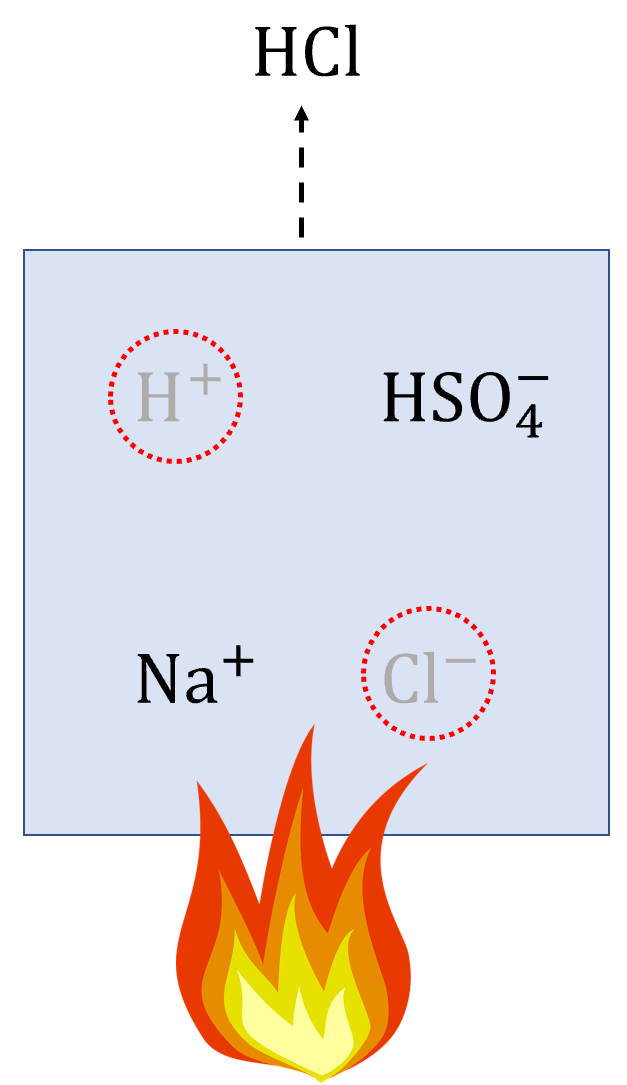
・反応の原理
濃硫酸と塩化ナトリウムを水中で混ぜると、それぞれが電離し、イオンができます。

ここからイオンを組み合わせて化合物を作ります。
この時、水素イオンと塩化物イオンを組み合わせると、塩化水素ができます。

塩化水素は揮発性の気体なので、加熱することによって、気体として回収することができます。
以上!!!
※「弱酸の遊離」との違い
弱酸の遊離との違いは、加熱するかどうかです!
揮発性酸の遊離は気体を揮発させる必要があるので、必ず加熱します。
〇そのほかの反応
他の4つの性質に関しては、理解しやすいと思うので、出てきたら確認してみてください!
<数理進学予備校イーズ WEBサイト>

Comments